Как растут кристаллы — Мир минералов
Кристаллы железного купороса или пищевой соды, растущие буквально на наших глазах и поражающие своими строгими геометрическими формами, никогда не перестанут удивлять.
Каким образом природе удается буквально за считанные часы создавать столь совершенные творения? Очень быстро, в течение нескольких дней, из приготовленного раствора вырастают кристаллы каменной (поваренной) соли и меди, сахара и алюмокалиевых квасцов.
Механизм роста кристаллов прост и сложен одновременно. В домашних и лабораторных опытах кристаллы обычно выращивают из пересыщенных водных растворов. Но они могут расти и из расплавов, кристаллы могут образоваться и при раскристаллизации гелей. При определенных условиях кристаллы могут менять свое строение, переходя из одной кристаллической формы в другую, с сохранением химического состава. Этот процесс носит название перекристаллизация.
Геометрический отбор растущих кристаллов при образовании друзы (схема)
Рост кристаллов (за исключением перекристаллизации) всегда является переходом из одного агрегатного состояния в другое (из газообразного — в твердое; из жидкого — в твердое). Для того, чтобы начался рост кристаллов из раствора, нужно, чтобы раствор был пересыщенным. Тогда, при снижении температуры, в растворе возникнут центры кристаллизации, микроскопические «зародыши» будущих великолепных кристаллов. Рассмотрим, для примера, поваренную (каменную) соль, формула которой известна каждому со школьных времен — NaCl. Если раствор пересыщен ионами натрия и хлора, они находятся на близком расстоянии друг к другу и между ними устанавливается химическая связь. Несколько молекул строятся в кубическую решетку, а к ним уже присоединяются другие ионы. Так образуется «зародыш» кристалла. Молекулы соединяются с друг с другом, в результате микроскопический кристаллик увеличивается и скоро становится видимым кубиком. Это идеальный вариант роста кристалла, который никогда не осуществляется на практике. Для того, чтобы получить идеальный кубик соли, нужно, чтобы «зародыш» неподвижно висел в растворе, не тонул и ни к чему не прикреплялся (хотя, в невесомости, возможно, когда-то и проведут такой опыт). К тому же, к кристаллу непрерывно и равномерно должен с определенной скоростью подаваться пересыщенный раствор и равномерно омывать его.
В условиях реального опыта (или в природе) раствор поступает к «зародышу» неравномерно, может меняться как скорость поступления, так и температура раствора. К тому же, в растворе образуется множество «зародышей». Поэтому из раствора вырастает множество кристаллов в виде агрегатов или друз (на твердой поверхности — основе), которые нарастают друг на друга, растут рядом, перекрывают друг друга.
При неравномерном, волнообразном поступлении пересыщенного раствора искажается форма кристалла, некоторые его грани не могут приобрести совершенные формы. Такой же процесс с образованием множества центров кристаллизации и зародышей происходит при росте кристаллов из насыщенной газами среды.
Самые совершенные кристаллы вырастают в тех местах, где раствор поступает равномерно и есть пространство для роста. Поэтому в любой друзе самыми большими и красивыми являются верхние кристаллы.
Исследования показывают, что самые большие и красивые кристаллы вырастают в условиях, когда центров кристаллизации мало, а пространство между ними велико.
Важен и еще один момент — чем дольше растет кристалл при сохранении оптимальных условий — тем совершеннее его грани. При очень быстром изменении температурных условий и концентрации вещества в растворе кристаллики вырастают очень мелкими (иногда их размеры не превышают несколько микрон).
В природе вырастают как очень мелкие, так и очень большие кристаллы. Так, кристаллы природного гипса могут достигать в длину 5-6 метров и более.
Цвет кристалла одного и того же минерала может быть различным из-за примесей, которые в момент его роста находились в растворе. Они встраиваются в кристаллическую решетку кристалла.
О том, как провести опыты по выращиванию кристаллов в домашних условиях, можно узнать, пройдя по ссылке.
Мексика, штат Чиуауа, пещера Найка. Кристаллы гипса
14. Как растут кристаллы. Кристаллы
14. Как растут кристаллы
Водяной пар, вода и лёд – это одно и то же вещество, молекулы которого состоят из 2-х атомов водорода и одного атома кислорода. Можно сказать про лёд, что это – твёрдая вода, или про воду, что это – жидкий лёд. Одно и то же вещество существует в трёх состояниях – газообразном, жидком и твёрдом. Вообще говоря, все вещества могут быть с большим или меньшим трудом получены во всех трёх состояних. Сталь и железо плавятся на металлургических заводах, жидкий воздух изготовляется для разных технических целей и развозится по городу в специальных теплоизолированных сосудах, твёрдый углекислый газ – это хорошо знакомый нам «сухой лёд»…
Почти любое вещество может при известных условиях дать кристаллы. Кристаллы можно получить из раствора или из расплава данного вещества, а также из его паров (например, чёрные ромбовидные кристаллы иода легко выпадают из его паров при нормальном давлении без промежуточного перехода в жидкое состояние).
Начните растворять в воде столовую соль или сахар. Не любое количество удастся растворить. При комнатной температуре (20°) вы сумеете растворить в гранёном стакане 70 граммов соли. Дальнейшие добавки соли растворяться не будут и улягутся на дне в виде осадка. Раствор, в котором дальнейшее растворение уже не идёт, называется насыщенным. Если изменить температуру, то изменится и степень растворимости вещества. Всем хорошо известно, что большинство веществ горячая вода растворяет значительно легче, чем холодная.
Представьте себе теперь, что вы приготовили насыщенный раствор, скажем, сахара при температуре 30° и начинаете охлаждать его до 20°. При 30° вы сможете растворить в 100 граммах воды 223 грамма сахара, при 20° растворяется 205 граммов. Тогда при охлаждении от 30 до 20° 18 граммов окажутся «лишними» и, как говорят, выпадут из раствора. Итак, один из возможных способов получения кристаллов состоит в охлаждении насыщенного раствора.
Можно поступить и иначе. Приготовьте насыщенный раствор соли и оставьте его в открытом стакане. Через некоторое время вы обнаружите появление кристалликов. Почему же они образовались? Внимательное наблюдение покажет, что одновременно с образованием кристаллов произошло ещё одно изменение – количество воды убыло. Вода испарилась, и в растворе оказалось «лишнее» вещество. Итак, другой возможный способ образования кристаллов – это испарение раствора.
Как же происходит образование кристаллов из раствора?
Мы сказали, что кристаллы «выпадают» из раствора; надо ли это понимать так, что неделю кристалла не было, а в одно какое-то мгновение он вдруг сразу возник? Нет, дело обстоит не так:
Не удаётся, разумеется, обнаружить глазом самые начальные моменты роста. Сначала немногие из беспорядочно движущихся молекул или атомов растворённого вещества собираются в том примерно порядке, который нужен для образования кристаллической решётки. Такую группу атомов или молекул называют зародышем.
Опыт показывает, что зародыши охотнее образуются при наличии в растворе каких-либо посторонних мельчайших пылинок. Всего быстрее и легче кристаллизация начинается тогда, когда в насыщенный раствор помещается маленький кристалл-затравка. При этом выделение из раствора твёрдого вещества будет заключаться не в образовании новых кристалликов, а в росте затравки.
Рост зародыша не отличается, конечно, от роста затравки. Смысл использования затравки состоит в том, что она «оттягивает» на себя выделяющееся вещество и препятствует, таким образом, одновременному образованию большого числа зародышей. Если же зародышей образуется сразу много, то они будут мешать друг другу при росте и не позволят нам получить крупных кристаллов.
Как распределяются на поверхности зародыша новые порции атомов или молекул, выделяющихся из раствора?
Опыт показывает, что рост зародыша или затравки заключается как бы в перемещении граней параллельно самим себе в направлении, перпендикулярном грани. При этом углы между гранями остаются постоянными. (Мы уже знаем, что постоянство углов – важнейший признак кристалла, вытекающий из его решетчатого строения.)
На рисунке 36[7] даны последовательные очертания трёх кристаллов одного и того же вещества при их росте. Подобную картину можно наблюдать в микроскоп. В случае, изображённом слева, число граней во время роста сохраняется. Средний рисунок даёт пример появления новой грани (вверху справа) и снова её исчезновения.

Рис. 36. Слева – рост кристалла с сохранением числа граней; в середине – грани по мере роста кристалла могут зарастать и появляться вновь; справа – обломок кристалла приобретает при росте правильную форму.
Очень важно отметить, что скорость роста граней, то есть скорость перемещения их параллельно самим себе, неодинакова у разных граней. При этом «зарастают» – исчезают именно те грани, которые перемещаются всего быстрее, например левая нижняя грань на среднем рисунке. Наоборот, медленно растущие грани оказываются самыми широкими, как говорят, наиболее развитыми.
Особенно отчётливо это видно на последнем рисунке. Бесформенный обломок приобретает ту же форму, что и другие кристаллы именно из-за анизотропии скорости роста. Вполне определённые грани развиваются за счёт других всего сильнее и придают кристаллу форму, свойственную всем образцам этого вещества.
Очень красивые переходные формы наблюдаются в том случае, когда в качестве затравки берётся шар, а раствор попеременно слегка охлаждается и нагревается. При нагревании раствор становится ненасыщенным, и идёт частичное растворение затравки. Охлаждение ведёт к насыщению раствора и росту затравки. Но молекулы оседают при этом по-иному, как бы отдавая предпочтение некоторым местам. Вещество, таким образом, переносится с одних мест шара на другие.
Сначала на поверхности шара появляются маленькие грани в форме кружков. Кружки постепенно увеличиваются и, соприкасаясь друг с другом, сливаются по прямым рёбрам. Шар превращается в многогранник. Затем одни грани обгоняют другие, часть граней зарастает, и кристалл приобретает свойственную ему форму (рис. 37).

Рис. 37. Как кристаллический шар превращается в правильный октаэдр.
При наблюдении за ростом кристаллов поражает основная особенность роста – параллельное перемещение граней. Получается так, что выделяющееся вещество застраивает грань слоями; пока один слой не достроен, следующий строиться не начинает.
На рисунке 38 показана «недостроенная» упаковка атомов. В каком из обозначенных буквами положений прочнее всего будет удерживаться новый атом, пристроившись к кристаллу? Без сомнения, в

Рис. 38. Как растёт кристалл.
В целом ряде случаев кристаллы образуются из расплавленной массы – из расплава. В природе это совершается в огромных масштабах: из огненной магмы возникли базальты, граниты и многие другие горные породы.
Начнём нагревать какое-нибудь кристаллическое вещество, например каменную соль. До 804° кристаллики каменной соли будут мало изменяться: они лишь незначительно расширяются, и вещество остаётся твёрдым.
Измеритель температуры, помещённый в сосуд с веществом, показывает непрерывный рост температуры при нагревании. При 804° мы обнаружим сразу два новых, связанных между собой явления: вещество начнёт плавиться, и подъём температуры приостановится. Пока всё вещество не превратится в жидкость, температура не изменится; дальнейший подъём температуры – это уже нагревание жидкости. Все кристаллические вещества имеют определённую температуру плавления. Лёд плавится при 0°, железо – при 1527°, ртуть – при –39° и т.д.
Как мы уже знаем, в каждом кристаллике атомы или молекулы вещества образуют упорядоченную упаковку и совершают малые колебания около своих средних положений. По мере нагревания тела скорость колеблющихся частиц возрастает вместе с размахом колебаний.
Это увеличение скорости движения частиц с возрастанием температуры составляет один из основных законов природы, который относится к веществу в любом состоянии – твёрдом, жидком или газообразном. Зная температуру, можно вычислить, с какой средней скоростью движутся частицы вещества. Скорости эти довольно велики – порядка нескольких сот метров в секунду. При нагревании тела, например от нуля до 1000°, скорость частиц возрастает более чем вдвое.
Когда достигнута определённая, достаточно высокая температура кристалла, колебания его частиц становятся столь энергичными, что аккуратное расположение частиц становится невозможным – кристалл плавится.
С началом плавления подводимое тепло идёт уже не на увеличение скорости частиц, а на разрушение кристаллической решётки. Поэтому подъём температуры приостанавливается. Последующее нагревание – это увеличение скорости частиц жидкости.
В интересующем нас случае кристаллизации из расплава явления наблюдаются в обратном порядке: по мере охлаждения жидкости её частицы замедляют своё хаотическое движение; при достижении определённой, достаточно низкой температуры скорость частиц уже столь мала, что некоторые из них под действием сил притяжения начинают пристраиваться одна к другой, образуя кристаллические зародыши. Пока всё вещество не закристаллизуется, температура остаётся постоянной. Эта температура, как правило, та же, что и температура плавления.
О том, как получить из твердеющего расплава крупные кристаллы, мы расскажем в следующей главе. Это не так просто.
Если не принимать специальных мер, то кристаллизация из расплава начнётся сразу во многих местах. Кристаллики будут расти в виде правильных, свойственных им многогранников совершенно так же, как мы это описывали выше. Однако свободный рост продолжается недолго: увеличиваясь, кристаллики наталкиваются друг на друга, в местах соприкосновения рост прекращается, и затвердевшее тело получает зернистое строение. Каждое зерно – это отдельный кристаллик, которому не удалось принять своей правильной формы.
В зависимости от многих условий и, прежде всего, от быстроты охлаждения твёрдое тело может обладать более или менее крупными зёрнами: чем медленнее охлаждение, тем крупнее зёрна. Размеры зёрен кристаллических тел колеблются от миллионной доли сантиметра до нескольких миллиметров. В большинстве случаев зернистое кристаллическое строение тел можно наблюдать в микроскоп. Твёрдые тела обычно имеют именно такое мелкокристаллическое строение.
Поделитесь на страничкеСледующая глава >
Как образуются кристаллы — причины образования, видео выращивания на дому
Кристаллы возникают при переходе вещества из любого агрегатного состояния в твердое. Главным условием образования кристаллов является понижение температуры до определенного уровня, ниже которого частицы (атомы, ионы), потеряв избыток теплового движения, проявляют присущие им химические свойства и группируются в пространственную решетку.
Способы и факторы зарождения кристаллов
При температурах, измеряемых тысячами градусов, ни одно из известных в природе веществ в кристаллическом состоянии существовать не может. Вторым важным условием является давление. Температура и давление – это термодинамические условия существования кристаллического вещества. Высоко нагретое вещество при охлаждении может проходить стадии газообразной смеси, жидкости, расплава, твердого состояния. Поэтому возможны три способа образования кристаллов.
- Кристаллизация путем возгонки – переход непосредственно из газообразного состояния к твердому. В этом случае кристаллы образуются прямо из пара, минуя жидкую фазу. Примером могут служить возгонка и перекристаллизация йода. В природе этот процесс происходит в кратерах, вулканических трещинах (налеты нашатыря, серы и др.). Зимой при ясной морозной погоде в воздухе образуются снежинки.
- Раскристаллизация в твердом состоянии – переход из твердого состояния в твердое. Здесь возможны два процесса. Первый – кристаллическое вещество может образовываться из аморфного. Так, с течением времени раскристаллизовываются стекла и содержащие стекло вулканические породы. Второй процесс – перекристаллизация: структура одних веществ разрушается и образуются новые кристаллы с иной структурой. Явления перекристаллизации широко распространены в природе и ведут к образованию новых минералов, горных пород и руд. Все метаморфические горные породы в той или иной степени являются перекристаллизованными. Под влиянием температуры, давления и других факторов известняк, например, переходит в мрамор, глинистые породы – в филлиты и кристаллические сланцы, кварцевые песчаники – в кварциты.
- Кристаллизация из расплавов и растворов – основной способ образования кристаллов в природе. Так образуются из огненно-жидкого силикатного расплава (магмы) массивные кристаллические породы – граниты. На дне озер, заливов и в море отлагаются кристаллы солей. Из расплавов и растворов выращиваются искусственные кристаллы (например, технические и драгоценные камни: пьезокварц, карборунд, рубин, алмаз, сапфир и др.).
Таким образом, основное условие зарождения – переохлаждение или перенасыщение. Зарождение кристаллов – переохлаждение или перенасыщение. Зарождение кристаллов может идти самостоятельно. Но иногда для роста кристаллов достаточным бывает наличие мельчайших кристалликов самого кристаллизуемого вещества или близких к нему по строению частиц других твердых веществ. Процесс образования кристаллов проходит скачкообразно, с выделением энергии, с перегруппировкой частиц, с резким изменением первоначальных свойств. Кристаллизационная способность у различных веществ неодинакова, она определяется количеством центров кристаллизации, образующихся в единицу времени в единице объема, и скоростью роста кристаллов. При большой скорости образования центров кристаллизации возникает много мелких кристаллов, при малом количестве центров возникают крупные кристаллы.
Как вырастить кристалл из соли дома
Можно самостоятельно проводить опыты по выращиванию кристаллов. Предварительно приготовляется измельченная в порошок навеска той или иной соли (квасцы, медный купорос и др.). Навеску насыпать в химически стеклянный или фарфоровый стакан и налить с помощью градуированной мензурки требуемое количество воды. Покрыв круглым (часовым) стеклом стакан, нагрейте его содержимое, чтобы ускорить растворение соли в воде. Затем полученный раствор профильтруйте.
Таблица 1 — Растворимость солей (в граммах) в 100 см3 воды.
Температура, ⁰С | Калиево-алюминиевые квасцы KAl[SiO4]·12H2O | Натровая селитра NaNO3 | Сернокислый магний MgSO4·7H2O | Медный купорос CuSO4·5H2O |
| 0 | 3,9 | 73 | 76,9 | 31,6 |
| 10 | 9,5 | 80,6 | 93,8 | 37 |
| 20 | 15,1 | 88,5 | 115,9 | 42,3 |
| 30 | 22 | 96,6 | 146,3 | 48,8 |
| 40 | 30,9 | 104,9 | 179,3 | 56,9 |
Отфильтрованную жидкость поместите в специальный стакан с широким дном и низкими стенками. В стакане раствор остывает и интенсивно испаряется, чему способствует характерная форма стакана, создающая большую поверхность испарения. В результате охлаждения и испарения получается сначала насыщенный, а затем перенасыщенный раствор (в нем содержится избыток растворенного вещества). При этом в кристаллизаторе начинают выпадать кристаллики. На следующий день (после приготовления раствора) нужно выбрать несколько или один из выпавших кристалликов, слить осторожно раствор в чистый кристаллизатор и поместить туда отобранные кристаллы – «завтраки». «Завтраками» называются твердые частицы, способные вызывать кристаллизацию. Для получения хорошо ограненного (изометричного) кристалла следует выращивать его на волоске, или нитке-шелковинке. Кристаллы, выращенные на дне сосуда, будучи стеснены в росте, приобретут неправильную форму (сплюснутые, вытянутые). По истечении некоторого срока, когда раствора станет мало, следует приготовить свежий раствор и перенести в него кристалл. Список оборудования для выращивания кристаллов: реактивы, ступка (фарфоровая), весы с разновесами (аптекарские), два стакана (химических или фарфоровых), мензурка, горелка, асбестовая сетка, круглое часовое стекло, стеклянная палочка для размещения раствора, воронка, фильтровальная бумага, штатив для воронки, стакан с широким дном, пинцет, термометр. Удобный материал для получения хорошо образованных кристаллов представляют алюминиевые квасцы. Растворимость квасцов в горячей воде значительно больше, чем в холодной, поэтому мы можем ускорить процесс, охлаждая насыщенный раствор. Растворите квасцы в горячей воде до пределов растворимости; получится насыщенный раствор. Опыт показывает, что в 200 г горячей воды можно растворить 25 г квасцов. На нитках-шелковинках, опущенных в раствор, вырастают кристаллы правильной формы, свойственной квасцам – октаэдры. С нитки удалите мелкие и неправильные кристаллы и оставьте один лучший, который будет постепенно нарастать. Вещество квасцов равномерно оседает на гранях свободно растущего кристалла. При охлаждении насыщенного раствора (75 г хромовых квасцов на 20 г воды) до температуры 11⁰С на дно сосуда выпадают корки мелкозернистых кристаллов. Правильные кристаллы хромовых квасцов в виде октаэдров фиолетового цвета растут на нитках, опущенных в раствор. Кристаллы алюминиевых квасцов могут расти в растворе хромовых и наоборот, так как у тех и других одинаковый тип пространственной решетки. Поместите растущий на нитке фиолетовый кристалл хромовых квасцов в насыщенный раствор алюминиевых квасцов – вы получите двухслойный кристалл с фиолетовым внутренним октаэдром и наружным бесцветным.
Наиболее удачный результат получается при выращивании кристаллов медного купороса из раствора, концентрацией 29,2% при охлаждении его до 13,5⁰С. В 200 г воды при подогревании растворите 82,5 г растертого в порошок медного купороса. Раствор пропустите через бумажный фильтр. Спустя 14-15 часов выпадут хорошо образованные кристаллы до 1,5 см в длину. Кроме квасцов и медного купороса, хорошо кристаллизуется двухромовокислый калий. Опыт по самоогранению кристалла: придайте выращенному кристаллу квасцов (обтачиванием напильником) форму шара, снова опустите его в насыщенный маточный раствор и следите за его ростом. Через 1-2 дня вы заметите, что на шарике появляются грани и через неделю вместо шарика снова образуется правильный октаэдр.
Как растут кристаллы.
ВЫРАЩИВАНИЕ КРИСТАЛЛОВ
В ДОМАШНИХ УСЛОВИЯХ
Кристалл ,как загадочная и прекрасная часть природы, издревле привлекал внимание людей.
Кристалл обычно служит символом неживой природы. Однако грань между живым и неживым установить очень трудно, и понятие «кристалл» и «жизнь» не являются взаимоисключающими.
Природные кристаллы всегда возбуждали любопытство у людей. Их цвет, блеск и форма затрагивали человеческое чувство прекрасного, и люди украшали ими себя и жилище. С давних пор с кристаллами были связаны суеверия; как амулеты, они должны были не только ограждать своих владельцев от злых духов, но и наделять их сверхъестественными способностями.

Позднее, когда те же самые минералы стали разрезать и полировать, как драгоценные камни, многие суеверия сохранились в талисманах «на счастье» и «своих камнях», соответствующих месяцу рождения. Все драгоценные природные камни, кроме опала, являются кристаллическими, и многие из них, такие, как алмаз, рубин, сапфир и изумруд, попадаются в виде прекрасно ограненных кристаллов.
Наиболее известные примеры кристаллов: лед, алмаз, кварц, каменная соль. Большинство твердых тел не обладает характерной для кристаллов правильной геометрической формой многогранника с плоскими гранями и острыми ребрами. Слово «кристалл» происходит от греческого – «лед».
Природа кристаллов
Кристаллические вещества – это твердые тела, в которых частицы ( атомы, молекулы и ионы) периодически правильно повторяются в трех измерениях, образуя бесконечную структуру. Частицы, расположенные в пространстве в определенном порядке, образуют кристаллическую решетку.
КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА – это регулярное расположение в пространстве атомов, определяющее специфику состояния вещества, называемого твердым телом.
Симметрия и порядок – вот отличительные характеристики кристаллов. Симметричными называют тела, состоящие из равных, одинаковых частей, которые могут быть совмещены друг с другом. Существует много различных элементов симметрии : плоскость , ось, центр симметрии, трансляция и другие.
Все кристаллы симметричны. Это значит , что в них можно найти различные элементы симметрии. Элементы симметрии могут сочетаться друг с другом только по строгим математическим законам. Всего таких сочетаний для кристаллических структур может быть 230. Их называют «Федоровскими пространственными группами» в честь кристаллографа Федорова, который одновременно с немецким математиком Шенфлисом в конце XIX в. вывел эти законы.

В кристаллической решетке можно выделить наименьший параллелепипед, при перемещении ( трансляции ) которого в трех измерениях получится весь кристалл. Такая структурная единица называется элементарной ячейкой. Всего существует 14 элементарных трехмерных геометрических ячеек, или решеток, названных по имени французского ученого, установившего их, Бравэ.
По типам химической связи кристаллы подразделяются на ионные (обычная поваренная соль ), ковалентные кристаллы (алмаз, кремний), металлические, молекулярные кристаллы ( нафталин ). Разный тип связи в кристаллах приводит к различиям в свойствах твердых веществ.
Как растут кристаллы.
Кристалл – это твердое вещество, имеющие естественную форму многогранника. Химические связи кристаллов очень упорядочены и симметричны. Кристаллы бывают различных форм. Крупные одиночные кристаллы, имеющие свою правильную форму, в природе встречаются очень редко. Но такой кристалл можно вырастить в искусственных условиях. Кристаллизация может происходить из раствора, расплава, а также из газообразного состояния вещества. Рассмотрим кристаллизацию из раствора.
В данном объёме той или иной жидкости при постоянной температуре и давлении может раствориться не больше определённого количества того или иного кристаллического вещества. Полученный при этом раствор называют насыщенным.Кристалл, помещённый в насыщенный раствор, не будет ни расти, ни растворяться в нём. Если повысить температуру жидкости, то растворимость её
повышается, поэтому имеющееся количество растворённого вещества уже не будет насыщать раствор. Кристалл, помещённый в ненасыщенный раствор, начнёт
в нём растворяться. Если насыщенный раствор охладить, он станет пересыщенным. Пересыщенные растворы могут сохраняться в замкнутых сосудах долгое время, не кристаллизуясь. Однако достаточно попасть в раствор
малейшей частицы кристалла, как раствор немедленно начнёт кристаллизоваться. Таким образом, пересыщение раствора является необходимым, но достаточным условием для кристаллизации. Чтобы кристаллизация началась,
нужно внести в раствор затравку — небольшой кристалл растворённого вещества. Из раствора кристалл выращивают обычно таким образом. Вначале в воде растворяют достаточное количество кристаллического вещества. При этом раствор подогревают до тех пор, пока вещество полностью не растворится. Затем раствор медленно охлаждают, переводя его тем самым в пересыщенное состояние. В пересыщенный раствор подмешивают затравку. Если, в течение всего времени кристаллизации, поддерживать температуру и плотность раствора одинаковыми во всём объёме, то в процессе роста кристалл примет правильную форму.
Дата добавления: 2016-09-06; просмотров: 3187;
Похожие статьи:
Кристаллы в природе и применение человеком
Эти удивительные вещества, созданные природой, до такой степени стали частью нашей жизни, что, сталкиваясь с ними практически ежедневно, мы не всегда задумываемся об их происхождении. Может, тебе приходилось обращать внимание на белый налет в кастрюле или на дне стакана после испарения соленой воды или очень сладкого чая? Если внимательно рассмотреть этот налет под лупой, то можно увидеть очень мелкие кристаллики соли или сахара. Крупинки соли и сахара, песок и снежинки, минералы и драгоценные камни — вот далеко не полный список кристаллов.
Что такое кристалл?
Кристалл — это твердое вещество, все мельчайшие частицы которого (молекулы, атомы или ионы) находятся в строго определенном, повторяющемся порядке. Именно такая структура позволяет формировать кристаллы уникальной формы.

Кристаллы морской соли
Почему у каждого кристалла своя форма?
Все кристаллы растут, но каждый из них растет со своей скоростью и в определенном направлении. Во время роста любого кристалла на его поверхности самопроизвольно образуются плоские грани, а сам кристалл принимает какую-либо геометрическую форму. Это означает, что грани кристалла растут в строго определенном направлении. Ученые неоднократно убеждались в этом в ходе следующего опыта. У стандартного кристалла геометрической формы они обрезали все углы, превратив его в шар, и поместили в раствор или расплав того же вещества.
Спустя некоторое время на поверхности шара стали образовываться ровные площадки граней кристалла. По мере роста граней площадки становились все больше и больше и постепенно соединились в многогранник неправильной формы. Чаще всего кристаллы вынужденно принимают такую форму. А происходит это потому, что одни грани растут быстрее других и мешают их свободному росту.

Драгоценные камни
Правильный многогранник может образоваться только в том случае, если ничто не мешает его росту. А если один кристалл столкнулся с другим, то больше расти в сторону этого кристалла он не может, поэтому меняет направление. В результате такого роста и образуются многогранники разной формы.
Как образуются кристаллы?
В недрах Земли находится магма, в процессе медленного остывания и затвердевания которой образуются кристаллы различных минералов с разным кристаллическим строением. Почему так происходит? Ты уже знаешь, что у каждого вещества своя температура плавления, или кристаллизации, или затвердевания. Поэтому все вещества, находящиеся в магме, затвердевают по очереди, в соответствии с той температурой, при которой они способны принять кристаллическую форму. Большинство из таких кристаллов является драгоценными камнями.

Листья покрытые кристаллами воды (инеем)
Кристаллы также могут образовываться из пара. Так, например, пар, который ты выдыхаешь во время сильных морозов, превращается в небольшие белые хлопья. Во время первых осенних заморозков трава и ветви низкорослых кустарников могут покрыться удивительными кристаллами инея, который исчезает по мере повышения температуры.
Испарение из раствора — еще один способ образования кристаллов. Например, после испарения воды из насыщенного соляного раствора на дне емкости останутся кристаллы соли. Подобные процессы происходят и в природе. Под лучами жаркого летнего солнца вода в морях и соляных озерах начинает испаряться. Кристаллы соли сначала плавают на поверхности воды, а затем оседают на дно.
Так образуются природные месторождения солей.
В чем секрет уникальности кристаллов?
Уникальность кристаллов заключается в их особой форме и гранях, которые они образуют. Если внимательно присмотреться к кристаллам соли и сахара, то разницу можно увидеть даже без микроскопа.
Все кристаллические решетки представляют собой различные геометрические фигуры: треугольники, прямоугольники, квадраты, ромбы и т.д., причем форма зависит от типа молекул и атомов каждого вещества.
ЗАПОМНИ! Процесс образования кристалла называется кристаллизация. В природе кристаллы довольно часто образуются в момент охлаждения жидкости и ее последующего затвердевания: определенные молекулы жидкости собираются вместе в виде особой решетки, которая неоднократно повторяется.
Снежинкa
Одними из самых интересных и необычных кристаллов являются снежинки. Снежинки — это кристаллы льда в форме игл, призм, шестиугольников, пластинок и др.
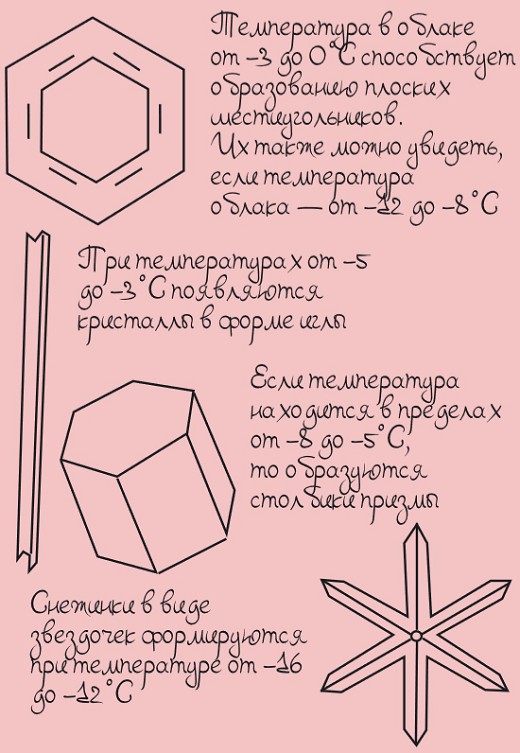
Форма снежинок при разной температуре
Когда молекулы воды кристаллизуются, они могут образовывать только трех или шестиугольные фигуры. Вот в этом и заключается основная причина шестиугольной формы снежинок!
От чего зависит форма снежинок?
Форма снежинок зависит от нескольких факторов:
- температуры, при которой снежинка образуется,
- высоты над уровнем моря,
- содержания водяного пара в облаке, в котором эта снежинка образовалась.
Падают снежинки очень медленно: их скорость составляет приблизительно 1 км/ч. Во время падения им приходится «переживать» разные температуры, поэтому форма снежинок постоянно меняется.
Жеода — чудо природы
Природа создала множество удивительных творений, и одно из них — жеоды. Жеоды — это необычные, полые внутри камни, полностью или частично заполненные разросшимися кристаллами. Жеоды бывают любой формы, но чаще всего встречаются округлые или овальные.
Снаружи жеоды не представляют собой ничего примечательного: они выглядят как обычные камни. Вся их красота становится очевидной только после распиливания. Иногда жеоды называют «шкатулки с сюрпризом»: ведь действительно неизвестно, какая красота в них скрывается.

Жеоды аметиста
Размеры жеод варьируются от 1 см до 1 м, самые маленькие экземпляры (менее 1 см) называют миндалинами. Кристаллы, образовавшиеся в жеодах, зависят от минерального вещества, изначально попавшего в подземные пустоты. Чаще всего встречаются жеоды кварца, аметиста, горного хрусталя, агата, халцедона.
Применение кристаллов
Кристаллы находят довольно широкое применение в технике и быту.
Так, благодаря высочайшей твердости алмазы, природные и искусственные, используются в промышленности для изготовления высокопрочных режущих инструментов, специальных опорных элементов для особо точных хронометров и других приборов, а ограненные алмазы (бриллианты) считаются одними из самых дорогих драгоценных камней. Рубины также являются драгоценными камнями. Они, как и алмазы, широко применяются в часовой промышленности, на фабриках по изготовлению химического волокна.
Кристаллы кварца нашли применение в радиотехнике.
Поделиться ссылкой
Как растут кристаллы
Как растут кристаллы
Балашова М.М. 11МБОУ Барвихинская СОШ
Иванова С.Н. 11МБОУ Барвихинская СОШ
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
I.Введение
В прошлом учебном году у нас в школе была экскурсия в музей Эксперементариум. После окончания экскурсии, я захотела сама сделать какой-то научный опыт. В магазинчике при музее я купила себе набор для выращивания кристаллов. Дома, с помощью мамы, следуя инструкции мы начали выращивать кристалл. Он рос 12 дней. Вопреки ожиданиям, он получился не такой большой и красивый, как на картинке. И тогда я решила попробовать вырастить кристалл еще раз, а заодно узнать из чего в нашей повседневной жизни мы можем вырастить кристаллы.
Итак…
Актуальность темы
Актуальность темы заключается в том, что в нашей повседневной жизни мы постоянно сталкиваемся с кристаллами, можно сказать, что все мы живем в мире кристаллов. Мы используем кристаллы в еде, в ракетостроении, самолетостроении, строительстве домов. Горные породы и минералы состоят из кристаллов. Они очень разные по строению, форме, качеству, но они все обладают качествами необходимыми для создания нужных в жизни вещей. А еще кристаллы-это красота, ведь драгоценные камни- это тоже кристаллы.
Объект исследования процесс выращивания кристаллов.
Предмет исследования: кристаллы.
Гипотеза
Вырастить кристаллы дома, из доступных веществ, можно.
Цель работы
Познакомиться с различными видами кристаллов. Вырастить кристаллы в домашних условиях.
Задачи
Узнать, что такое кристаллы.
Узнать в каких сферах жизни используются кристаллы.
Вырастить кристаллы в домашних условиях.
Создать презентацию на тему работы.
Методы исследования:
Изучение литературы по теме «Кристаллы».
Проведение опытов.
Наблюдение за ходом опытов.
Фиксирование результатов работы.
II. Основная часть
Кристалл, что это такое?
Что бы понять, что такое кристаллы, я зашла в интернет и прочитала статью в Википедии.
Кристаллы- (от греческого «кристаллос», «лед», в дальнейшем «горный хрусталь) твердые тела, атомы, которых расположены в определенном положении в пространстве. Кристаллы имеют разную величину и форму: какие-то маленькие и острые, какие-то большие и могут достигать нескольких метров в длину. Ученные, которые занимаются изучением кристаллов поделили их на две категории: «кристалл идеальный» и «кристалл реальный».
Идеальный кристалл- это кристалл с полным набором всех качеств, свойств и характеристик, присущих данному виду кристаллов. Он имеет совершенную структуру и лишен всяких дефектов строения (Приложение №1).
Реальный кристалл- это тот кристалл, который существует в реальной жизни. В отличие от идеального, у него есть некоторые дефекты. У него не безупречные грани, а симметрия не такая идеальная. Но несмотря на все его недостатки, в реальном кристалле есть самое его главное свойство- частиц в нем располагаются в закономерном порядке Приложение №2).
Откуда же берутся кристаллы?
Кристаллы природные (натуральные) зарождаются в недрах земли, в течение долгого периода времени, при условии очень высокой температуры и большого давления.
А искусственные кристаллы люди могут выращивать в домашних условиях.
В природе существует множество веществ, имеющих кристаллическое строение. Самым распространенным веществом, обладающим способностью образовывать кристаллы, является обычная вода. Мы видим их зимой- это снежинки и льдинки.
Кроме воды кристаллы могут образовывать многие металлы, например, медь и железо, соли (Приложение № 3).
Из истории кристаллов.
Наука о кристаллах началась с изучения горного хрусталя (Приложение № 4). Его блестящие бесцветные кристаллы впервые были найдены еще в древности среди вечных снегов в Швейцарских Альпах. Некоторые кристаллы были настолько большими, что их с трудом могли поднять несколько силачей.
Самые знаменитые кристаллы- алмазы, которые после огранки превращаются в бриллианты (Приложение № 5). В течение многих веков люди пытались разгадать тайну этих драгоценных камней. Когда же было наконец установлено, что алмаз-одна из разновидностей углерода, в это поверили не сразу! Действительно, алмаз- символ не только богатства, но и необыкновенной твердости. Если же взять другую, наиболее распространенную в природе кристаллическую разновидность углерода- графит, то на память прежде всего приходят грифели карандашей- черные, жирные на ощупь и очень мягкие. Оказалось, что сверкающие кристаллы, с которыми связано столько романтических (и кровавых) историй, и невзрачный черный графит состоят из одних и тех же атомов углерода. Решающий опыт провел в 1772 году знаменитый французский химик А.Л. Лавуазье. Он обнаружил, что при сжигании алмаза и обычного угля получается одно и то же вещество-углекислый газ.
Блестящие кристаллы алмаза находили на территории современной Индии еще 7 тысячелетий назад. Людей поражали их блеск, прозрачность (до изобретения стекла было еще далеко) и необычайная твердость. Алмаз унаследовал свое название от греческого слова «адамас», что означает «нерушимый, непреодолимый». Неудивительно, что в древности этому камню приписывали чудесные свойства, он был предметом поклонения. Самые большие и красивые образцы вставляли в глазницы гигантских статуй Будды.
Искусственным путем люди научились получать очень многие драгоценные камни. Например, подшипники для часов и других точных приборов уже давно делают из искусственных рубинов. Получают искусственно и прекрасные кристаллы, которые в природе вообще не существуют. Например, фианиты (их название происходит от сокращения ФИАН- Физический институт Академии наук, где их впервые получили). Бесцветные фианиты на глаз трудно отличить от алмаза- так красиво они «играют» на свету.
В чем секрет уникальности кристаллов?
Уникальность кристаллов заключается в особой форме их граней. Если внимательно присмотреться к кристаллам соли и сахара, то разницу можно увидеть даже без микроскопа. Одним из самых интересных и необычных кристаллов являются снежинки (Приложение № 6). Эти кристаллы льда в форме игл, призм, шестиугольников или пластинок. Каждую зиму, особенно во время суровых морозов, сложные симметричные объекты в форме и 6-тиуголных пластинок, покрывают поверхность земли слоем мягкого и пушистого снега. Они состоят из тоненьких ледяных кристалликов, собранных вместе.
Известный немецкий астроном Иоганн Кеплер еще в 17 веке написал работу, которую посвятил шестиугольным снежинкам, тем самым оказал значительное влияние на развитие кристаллографии – науки о возникновении, структуре и свойствах кристаллических структур. Через два столетия выдающийся фотограф Уильям Бентли подарил миру возможность любоваться этими прекрасными творениями природы. Ему удалось сделать фотографии тысячи снежинок, где одна не повторяет другую. Для этого фотограф ловил снежинки на черный бархат и делал удивительные снимки. Почему же снежинки шестиугольные? В составе молекулы воды содержится два атома водорода и один-кислорода. Когда молекула воды кристаллизуется, она может образовывать только трех-или шестиугольные фигуры. Вот в этом и заключается основная причина шестиугольной формы снежинок. Снежинки зарождаются высоко в облаках при очень низких температурах. Происходит это следующим образом: на мельчайших частичках пыли при отрицательных температурах формируются кристаллики льда. Сначала под действием потоков воздуха эти кристаллики начинают опускаться, из-за чего немного подтаивают и сливаются друг с другом. Затем кристаллы снова поднимаются и подмерзают, при этом увеличиваются в размере, так как на них конденсируется влага из воздуха.
Как только кристаллы становятся слишком тяжелыми и не могут больше удерживаться в облаке, они начинают падать. Но долететь до земли снежинки могут только в том случае, когда температура воздуха ниже нуля.
Кристаллы и их применение в быту.
Мы живем на Земле, которая сложена из кристаллических пород: мы ходим по кристаллам, строим из кристаллов, выращиваем кристаллы в лабораториях, едим кристаллы. Так, например, горные породы состоят из кристаллов: песчаники, известняк, гранит.
Кристаллы находят довольно широкое применение в технике и быту. Так, благодаря сверхвысокой твердости алмазы, природные и искусственные, используются в промышленности для изготовления высокопрочных режущих инструментов, специальных опорных элементов для особо точных хронометров и других приборов, а ограненные алмазы- бриллианты- считаются самыми дорогими драгоценными камнями.
Рубины также являются драгоценными камнями. Они, как и алмазы, широко применяются в часовой промышленности, на фабриках по изготовлению химического волокна. Кристаллы кварца нашли применение в радиотехнике. Все мы слышали выражение «жидкокристаллический дисплей или экран». Какие же кристаллы считаются жидкими? Так называют не совсем обычные вещества, которые соединяют в себе свойства как жидкости, так и кристаллических тел. От жидких тел они унаследовали текучесть, а от твердых- упорядоченность в ориентации молекул. Самое широкое применение жидкие кристаллы получили в плоских телевизионных кранах, индикаторах часов, калькуляторов.
Как образуются кристаллы?
Ученых давно интересовало, как образуются кристаллы, почему разные вещества дают кристаллы разной формы, а некоторые вовсе не образуют кристаллов, что надо сделать, чтобы кристаллы получились большими и красивыми. Исследования показали, что кристаллы-это вещества, в которых мельчайшие частички (атомы, ионы или молекулы) упакованы в определенном порядке. Именно этот порядок определяет форму кристалла.
В природе кристаллы довольно часто образуются в момент охлаждения жидкости и ее последующего затвердевания: молекулы жидкости соединяются в виде особой решетки, которая неоднократно повторяется.
Так в процессе медленного остывания и затвердевания магмы в недрах нашей планеты образуются кристаллы минералов с разным кристаллическим строением, большинство из которых являются драгоценными камнями.
Кристаллы также могут образовываться из пара. Например, пар, который мы выдыхаем при сильных морозах, превращается в небольшие белые хлопья. Во время первых осенних заморозков трава и ветви низкорослых кустарников могут покрыться удивительными кристаллами воды, которая испаряется по мере повышения температуры.
Испарение из раствора- еще одна форма образования кристаллов. Например, после испарения воды из насыщенного соляного раствора на дне емкости останутся кристаллы соли. Можно, например, просто оставить открытый сосуд с раствором при комнатной температуре на длительный срок- вода при этом будет испаряться очень медленно (особенно если сосуд с раствором неплотно прикрыть листом бумаги, который заодно будет защищать раствор от пыли). В промышленных масштабах большие кристаллы часто получают охлаждением расплавленного вещества. Форма этого кристалла (его называют «булей») определялась условиями его роста. Если «булю» расколоть, получатся прозрачные кубические кристаллы. Такую форму имеют рубиновые «були», выращенные при высокой температуре; из искусственных рубинов делают, например, подшипники для осей в часах. Подобные процессы происходят и в природе. Под лучами жаркого летнего солнца вода в морях и соляных озерах начинает испаряться. Кристаллы соли сначала плавают на поверхности воды, а затем оседают на дно. Так образуются природные месторождения солей.
Конечно, хочется получить большой и красивый кристалл побыстрее – но тут уж ничего не поделаешь: придется запастись терпением.
Многие видные ученые, внесшие большой вклад в развитие химии, минералогии, других наук, начинали свои первые школьные опыты именно с выращивания кристаллов. Опыты эти относительно просты, но их результаты могут вызвать удивление и восхищение даже у людей, весьма далеких от химии и никогда прежде не интересовавшихся этой наукой.
Опыт 1.
Сахарные кристаллы- самые настоящие леденцы на палочках, которые можно сделать дома.
Я решила вырастить кристаллы из сахара сама.
Для этого я взяла 2 деревянные палочки; кастрюлю; 2 пустых стакана.
Для начала мы приготовили сироп из сахара. Для этого в кастрюлю мы налили воду и насыпали несколько ложек сахара. Поставили кастрюлю на небольшой огонь и растворили сахар.
На плотную бумагу высыпали небольшое количество сахара. Обмакнули деревянные палочки в сироп, затем тщательно обваляли их в сахаре. Кристаллы сахара равномерно распределились по всем сторонам палочек.
В кастрюлю насыпали сахар и влили воду. Поставили кастрюлю на небольшой огонь и медленно помешивая, растворили весь сахар. Затем всыпали еще сахар и варили до тех пор, пока сахар не растворился полностью.
Затем в каждый стакан с сиропом опускаем палочку с сахарными кристаллами так, чтобы до дна оставалось 1,5-2 см. и закрепить палочки при помощи плотной бумаги. В один из стаканов я добавила пищевой краситель синего цвета.
За кристаллами я наблюдала 2 недели. Каждый день на палочке появлялись все новые и новые кристаллики. Через две недели у нас получились два красивых леденца.
Вывод: Растворяя сахар в воде, мы получили сироп, перенасыщенный раствор сахара. Вода удерживает сахар только в горячем состоянии. Остывая, он выходит из раствора и оседает на заготовке- деревянной палочке с сухими кристаллами сахара. Чем медленнее удалятся вода, тем лучше получаются кристаллы.
Опыт 2.
Параллельно опыту с сахаром, я решила вырастить кристалл из обычной соли.
Для опыта с солью, мне понадобилась теплая вода, соль, стакан, нитка и деревянная палочка.
Мы взяли крупную соль, высыпали ее в стакан с теплой водой. Соль растворять до тех пор, пока она уже перестает растворяться.
Насыщенный раствор перелили в другую емкость, где мы выращивали кристалл.
Выбрать из соли самый большой кристаллик для затравки.
Кристаллик обмотали ниткой.
В соляной раствор опустили нитку с затравкой.
Емкость с кристаллом закрыли плотной бумагой и перенесли кристалл туда, где нет яркого света и сквозняков.
Кристалл соли рос три недели. В отличие от кристаллов сахара он вырос не большим.
Вывод: Ворсинки нитки становятся центрами кристаллизации следующим образом. Беспорядочно двигающиеся молекулы растворенного вещества начинают цепляться за ворсинки и собираться в том порядке, который необходим для образования кристаллической решетки. Сначала на них образуются мельчайшие кристаллики, которые постепенно увеличиваются в размерах.
Выводы
В процессе работы над темой, я очень много узнала о мире кристаллов. Я узнала, что мы окружены кристаллами, что в нашей повседневной жизни так же используются кристаллы. Так же я узнала, что многие химики начинали свои опыты именно с кристаллов.
В ходе работы я подтвердила гипотезу, что можно выращивать кристаллы в домашних условиях. Я научилась выращивать кристаллы. Выращенные мной кристаллы получились разной формы и размеров. Процесс выращивания кристаллов дома — это увлекательное и познавательное занятие. Эта работа сделала меня более наблюдательной, открыла мне мир науки. Я думаю, что приобретенные мной в процессе работы знания, пригодятся в дальнейшей учебе.
Список литературы
Л.Д. Вайткене., «Химия», Москва, «АСТ», 2017.
Китайгородский А.И., «Кристаллы»., М., «Научно-Популярная Библиотека», 1950.
И.А. Леенсон., «Удивительная химия», Москва, «ЭНАС-КНИГА», 2016.
4. Петров Т.Г., «Выращивание кристаллов из растворов», Л., «Недра», 1983
Приложение № 1
Приложение № 2
Приложение № 3
Приложение № 4
Приложение № 5
Приложение № 6
Приложение № 7
Просмотров работы: 39
Кристаллы растут » Детская энциклопедия (первое издание)
Строение и свойства кристаллов Выращивание кристалловКак образуются кристаллы?
Когда испаряется («высыхает») соленая вода в кастрюле или сладкий чай в стакане, на стенках кастрюли или па дне стакана остается белый налет. В лупу можно разглядеть в нем мелкие блестящие кристаллики соли или сахара.
Если медленно испарять раствор квасцов или медного купороса, то через несколько дней из раствора вырастут довольно большие кристаллы.
Нетрудно сделать опыт выращивания кристаллов из расплава. Насыпьте в стеклянную колбу белого порошка водного гипосульфита натрия (фиксажа), который можно купить в магазине фотографических принадлежностей. Осторожно нагрейте колбу. Гипосульфит расплавится и превратится в жидкость. Заткните колбу ватой и быстро остудите ее под струей холодной воды. Если не трясти колбу, гипосульфит будет остывать, не кристаллизуясь. Когда он совсем остынет, бросьте в колбу крупинку твердого гипосульфита. Эта крупинка начнет быстро расти, от нее вытянутся иголки, лучи, лепестки; такие же иглы, пластинки, звезды, многогранники возникнут и в других местах колбы. Они будут быстро расти во все стороны, сталкиваться друг с другом, и через несколько минут вся жидкость затвердеет. Эти звездочки и многогранники — кристаллы гипосульфита, выросшие из расплава.
Узорная шестилучевая звездочка снежинки поражает своей симметрией.
Кристаллы могут образоваться и из пара. В морозном воздухе пар, который выдыхает человек, оседает белыми хлопьями. Они представляют собой скопления мелких кристаллов снега или льда, образовавшихся и выросших на морозе из водяного пара. Иней — это тоже закристаллизовавшиеся пары воды. Облака, которые мы видим на небе, — это скопление водяных капель или кристалликов снега; а снежные кристаллики вырастают либо из этих капель, либо из водяных паров, содержащихся в атмосфере.
Обледенение самолетов в арктических полетах — это тоже процесс роста кристаллов. В холодных верхних слоях атмосферы водяные пары могут долго сохраняться, не кристаллизуясь, но лишь только в эти пары врежется летящий самолет, как сейчас же начнется быстрый рост ледяных кристаллов, и в несколько минут самолет окажется облепленным грудой кристаллов льда.
Скорость роста кристалла по разным направлениям различна, так же как различны все другие свойства кристалла. В этом легко убедиться на опыте. Если обломать у кристалла все углы, обточить грани или выточить из кристалла шарик и поместить его в остывающий раствор или расплав того же вещества, кристалл начнет расти. Если бы скорость роста кристалла не зависела от направления, то шарик, вырастая, увеличивал бы свой объем, не изменяя формы. Он по-прежнему оставался бы шариком. Но опыт показывает, что это не так. На растущем кристаллическом шарике появляются крохотные плоские пятнышки — ровные площадки граней; в одних направлениях кристалл растет, в других он может растворяться. Постепенно увеличиваясь, расширяясь, грани встречаются друг с другом, и в конце концов весь шар превратится в многогранник; при этом разные грани растут с разной скоростью, почему и возникают различные формы кристаллов.
Таким образом, кристалл, лишенный своей многогранной формы, не теряет способности самоограняться. Многогранная форма кристалла зависит от того, что кристалл растет неравномерно, с различной скоростью по разным направлениям.
Итак, кристаллы растут. И замечательно, что они всегда растут в виде правильных симметричных многогранников, если только им ничто не мешает при росте. Как же растут кристаллы в природе?
В глубинах нашей планеты находится магма, т. е. сложный раствор-расплав множества различных веществ, дающий при остывании разные минералы с различным кристаллическим строением.
Почему же из однородной магмы получаются разные минералы? Каждое химическое вещество затвердевает или плавится при определенной температуре. Например, если вы будете нагревать кристалл льда, то до 0° кристалл остается неизменным. Но как только температура достигает 0°, кристалл вдруг намнет плавиться, причем, сколько бы мы ни грели дальше, температура льда не будет повышаться, пока весь кристалл не расплавится. Лишь когда весь кристалл превратится в воду, температура воды начнет повышаться. Если же мы будем охлаждать воду, то точно при 0° жидкость закристаллизуется, и ее температура будет неизменной, пока вся вода не превратится н лед, после чего температура снова начнет падать.
Также и любое кристаллическое вещество плавится и кристаллизуется при строго определенной температуре, характерной для него, например для кварца 1713° и т. д.
У некристаллических тел нет постоянной температуры плавления (а следовательно, и температуры кристаллизации), при нагревании они размягчаются постепенно. В стекле уже и до нагревания все атомы расположены беспорядочно. При охлаждении расплавленное стекло становится все более вязким и застывает постепенно.
Кристалл кварца в Минералогическом музее Академии наук СССР.
Кристаллическое же вещество затвердевает сразу при определенной температуре кристаллизации.
Когда в глубинах земли магма постепенно застывает, химические вещества, составляющие ее, затвердевают не все сразу, а поочередно, потому что температура кристаллизации их различна. Поэтому магма распадается на разнородные, почти всегда состоящие из кристаллов минералы.
Мы говорили, что кристаллы всегда растут в виде правильных многогранников, если только им ничто не мешает при росте. Но ведь если много кристаллов растет вместе, то, увеличиваясь, они начинают сталкиваться, теснить друг друга. Если кристалл столкнулся с соседним кристаллом, дальше в эту сторону он уже расти не может, а в другие стороны он еще будет расти, пока ему опять не встретится помеха. В результате кристалл вырастает в одни стороны больше, чем в другие: получаются неправильные многогранники, бесформенные зерна. Вот почему в горных породах или в твердых металлах кристаллические «зерна» обычно имеют неправильные очертания. Отдельные кристаллики хорошо видны в микроскоп и даже простым глазом, но правильных многогранников среди них очень мало, а чаще и совсем нет.
Но почему же мы все-таки говорим, что характерным свойством кристаллов является их многогранная форма?
Потому, что если бы это же самое кристаллическое зерно росло не в тесноте, а так, чтобы ему ничто не мешало, то оно приняло бы форму правильного многогранника. Неправильная форма — это вынужденная форма кристалла. Кристаллу не удалось вырасти многогранным потому, что соседние кристаллы мешали ему расти свободно.
Кристаллы, растущие в больших пустотах и трещинах в земле, не теснят друг друга: именно там образуются великолепные громадные Многогранники горного хрусталя, берилла, полевых шпатов и других минералов. В таких «хрустальных погребах» Северного Урала найдены, например, кристаллы горного хрусталя идеально правильной формы весом до 500 кГ. А летом 1945 г. на Волыни был найден кристалл кварца весом около 10 Т. Его длина 2,7 м, ширина 1,5 м.
В музее Горного института в Ленинграде хранится кристалл горного хрусталя высотой почти в метр; он долгое время служил тумбой у ворот одного из домов г. Свердловска. На Алтае был найден кристалл берилла длиной в 1,3 ж.
Озера и моря — это природные лаборатории, в которых происходит рост кристаллов из растворов. Южный Урал, Донбасс, Западная Сибирь, Закавказье, Средняя Азия изобилуют соляными озерами, в воде которых растворено множество солей. Летом, когда под лучами палящего солнца вода озер быстро испаряется, из раствора начинают выделяться кристаллы соли, совсем так же, как оседает соляная накипь на дне и стенках кастрюли.
Эти кристаллы плавают на поверхности озера, отлагаются на берегах, оседают на дне. Так путем кристаллизации из раствора возникают месторождения солей.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Строение и свойства кристаллов Выращивание кристаллов.
