Кислотно-основные индикаторы — Википедия
Материал из Википедии — свободной энциклопедии
Кислотно-основные индикаторы (pH-индикаторы[1]) — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). Индикаторы широко используют в титровании в аналитической химии и биохимии. Их преимуществом является дешевизна, быстрота и наглядность исследования. Однако из-за субъективности определения цвета и невысокой точности индикаторы pH не всегда удобны; поэтому для точного измерения pH используют pH-метры с цифровой индикацией.
 Измерение pH с помощью индикаторной бумаги
Измерение pH с помощью индикаторной бумагиKs{\displaystyle K_{s}}:
Ks=c(Ind−)⋅c(h4O+)c(HInd).{\displaystyle K_{s}={c(Ind^{-})\cdot c(H_{3}O^{+}) \over c(HInd)}.}
Индикаторы обычно используют, добавляя несколько капель водного или спиртового раствора, либо немного порошка (например, смесь мурексида с хлоридом натрия) к пробе исследуемого раствора. Так, при титровании, в аликвоту исследуемого раствора добавляют индикатор, и наблюдают за изменениями цвета в точке эквивалентности.
Другой способ применения — использование полосок бумаги, пропитанных раствором индикатора или смеси индикаторов и высушенных (например, Универсальный индикатор). Такие полоски выпускают в самых разнообразных вариантах — с нанесенной на них цветной шкалой — эталоном цвета (в том числе для окрашенных или мутных сред), или с напечатанными числовыми значениями рН; для точного измерения в узких диапазонах рН, и для ориентировочного исследования растворов; в рулончиках, коробках и пеналах, или в виде отрывных книжечек.
Современные индикаторные полоски могут быть изготовлены с красителем — индикатором, привитым к целлюлозе или иному полимеру. Это делает их устойчивыми к вымыванию, вплоть до многократного использования.
Кислотно-основные индикаторы (водные растворы)[править | править код]
Интервалы перехода цвета индикаторов[править | править код]
На рисунке приведены ориентировочные данные о существовании разных цветных форм индикаторов в водных растворах.
Более точные сведения (несколько переходов, численное значение pH) см. в следующем разделе.
Таблица значений рН перехода наиболее распространённых индикаторов[править | править код]
Приведены распространённые в лабораторной практике кислотно-основные индикаторы в порядке возрастания значений pH[2], вызывающих изменение окраски [3]. Римские цифры в квадратных скобках отвечают номеру перехода окраски (для индикаторов с несколькими точками перехода).
| Индикатор и номер перехода | х[4] | Цвет более кислой формы | Интервал pH и номер перехода | Цвет более щелочной формы | ||
|---|---|---|---|---|---|---|
| Малахитовый зелёный | жёлтый | 0,1-2,0 [l] | сине-зелёный | |||
| Метиловый фиолетовый | жёлтый | 0,13–0,5 [I] | зелёный | |||
| Крезоловый красный [I] | красный | 0,2–1,8 [I] | жёлтый | |||
| Метиловый фиолетовый [II] | зелёный | 1,0–1,5 [II] | синий | |||
| Тимоловый синий [I] | к | красный | 1,2–2,8 [I] | жёлтый | ||
| Тропеолин 00 | o | красный | 1,3–3,2 | жёлтый | ||
| Метиловый фиолетовый [III] | синий | 2,0–3,0 [III] | фиолетовый | |||
| (Ди)метиловый жёлтый | o | красный | 3,0–4,0 | жёлтый | ||
| Бромфеноловый синий | к | жёлтый | 3,0–4,6 | сине-фиолетовый | ||
| Конго красный | синий | 3,0–5,2 | к | красный | ||
| Метиловый оранжевый | o | красный | 3,1–(4,0)4,4 | (оранжево-)жёлтый | ||
| Бромкрезоловый зелёный | к | жёлтый | 3,8–5,4 | синий | ||
| Бромкрезоловый синий | жёлтый | 3,8–5,4 | синий | |||
| Лакмоид | к | красный | 4,0–6,4 | синий | ||
| Метиловый красный | o | красный | 4,2(4,4)–6,2(6,3) | жёлтый | ||
| Хлорфеноловый красный | к | жёлтый | 5,0–6,6 | красный | ||
| Лакмус (азолитмин) | красный | 5,0–8,0 (4,5-8,3) | синий | |||
| Бромкрезоловый пурпурный | к | жёлтый | 5,2–6,8(6,7) | фиолетовый | ||
| Бромтимоловый синий | к | жёлтый | 6,0–7,6 | синий | ||
| Нейтральный красный | o | красный | 6,8–8,0 | янтарно-жёлтый | ||
| Феноловый красный | о | жёлтый | 6,8–(8,0)8,4 | ярко-красный | ||
| Крезоловый красный [II] | к | жёлтый | 7,0(7,2)–8,8 [II] | тёмно-красный | ||
| α-Нафтолфталеин | к | жёлто-розовый | 7,3–8,7 | синий | ||
| Тимоловый синий [II] | к | жёлтый | 8,0–9,6 [II] | синий | ||
| Фенолфталеин[5] [I] | к | бесцветный | 8,2–10,0 [I] | малиново-красный | ||
| Тимолфталеин | к | бесцветный | 9,3(9,4)–10,5(10,6) | синий | ||
| Ализариновый жёлтый ЖЖ | к | бледно-лимонно-жёлтый | 10,1–12,0 | коричнево-жёлтый | ||
| Нильский голубой | синий | 10,1–11,1 | красный | |||
| Диазофиолетовый | жёлтый | 10,1–12,0 | фиолетовый | |||
| Малахитовый зелёный | сине-зелёный | 11,6-13,6 [ll] | бесцветный | |||
| Индигокармин | синий | 11,6–14,0 | жёлтый | |||
| Epsilon Blue | оранжевый | 11,6–13,0 | тёмно-фиолетовый | |||
- ↑ Юлия Блинохватова, Валерия Вихрева, Тамара Клейменова, Ольга Марковцева. Химия неорганическая и аналитическая. — Litres, 2017. — С. 33. — 66 с. — ISBN 9785040190010.
- ↑ Величины в круглых скобках взяты из книги «Краткий справочник химика», сост. В.И.Перельман, М.-Л., „Химия“, 1964.
- ↑ Точное значение рН перехода для большинства индикаторов несколько зависит от ионной силы раствора (I). Так, значение рН перехода, определяемое при I=0,1 (напр., раствор хлоридов натрия или калия) отличается от точки перехода в растворе с I=0,5 или I=0,0025 на 0,15…0,25 единицы рН.
- ↑ *Столбец «х» — характер индикатора: к—кислота, о—основание.
- ↑ Фенолфталеин в сильно щелочной среде обесцвечивается. В среде концентрированной серной кислоты также он даёт красную окраску, обусловленую строением катиона фенолфталеина, хотя и не такую интенсивную. Эти малоизвестные факты могут привести к ошибкам при определении реакции среды.
Универсальный индикатор[править | править код]
 Универсальная индикаторная бумага
Универсальная индикаторная бумагаШироко применяются смеси индикаторов, позволяющие определить значение pH растворов в большом диапазоне концентраций (1-10; 0-12). Растворами таких смесей — «универсальных индикаторов» обычно пропитывают полоски «индикаторной бумаги», либо сам индикатор наносится на край специальных полимерных полосок («визуальные индикаторные тест-полоски»)[1], с помощью которых можно быстро (с точностью до единиц рН, или даже десятых долей рН) определить кислотность исследуемых водных растворов. Для более точного определения полученный при нанесении капли раствора цвет индикаторной бумаги немедленно сравнивают с эталонной цветовой шкалой.
Антоцианы и другие растительные пигменты способны менять цвет в зависимости от рН среды (клеточного сока). Антоцианы имеют преимущественно красный цвет в кислой среде и синий в щелочной. Сок из красной капусты или столовой свёклы нередко используют в качестве индикатора при начальном обучении химии.
- Бейтс Р., Определение рН. Теория и практика, пер. с англ., 2 изд., Л., 1972
Как пользоваться лакмусовой бумагой, чтобы измерить pH
Для нормального обмена веществ человека необходимо, чтобы кислотно-щелочной баланс поддерживался в определенных рамках.
Индикаторная лакмусовая бумага обеспечивает быстрый и экономичный способ измерения рН (водородный показатель) любой необходимой жидкости и смесей жидкостей (моча, слюна, кал, сперма, кислотность влагалища, грудное молоко, растворы, вода, напитки и т.п.).
Лакмусовая бумага — необходима как в семье, так и у специалиста, проводящего исследование пациента, применима в химических лабораториях, используется для исследовательской деятельности.
В химии есть вещества, обладающие способностью менять свою окраску в присутствии кислот и щелочей. Эти вещества называются индикаторами и применяются для определения реакционной среды. Среда может быть кислой, щелочной и нейтральной. Этими веществами пропитывают фильтровальную бумагу.
Лакмус — это красящее вещество, добываемое из некоторых видов лишайника. Состав его сложен. Лакмус — слабая кислота, которой пропитывают бумагу.
Как пользоваться индикаторной бумагой:
Необходимо окунуть узкой полоской бумаги в необходимый раствор на две-три секунды. Сравнить с прилагаемой цветовой шкалой и вычислить значения.
НОРМЫ pH
Растворы и жидкости в отношении их кислотности считаются:
· нейтральными при рН = 7
· кислыми при pH < 7
· щелочными при рН > 7
Кислотность мочи
Если уровень рН мочи колеблется в пределах 6,0 — 6,4 по утрам и 6,4 — 7,0 по вечерам, то организм функционирует нормально. Наиболее оптимальный уровень — слегка кислый, в пределах 6,4 — 6,5. Значение рН мочи ниже 5,0 говорит о ее резкой закисленности, выше 7,5 — о ее резко щелочной реакции.
Реакция мочи определяет возможность образования камней: уратных — в кислой, оксалатных — в нейтрально-кислой, фосфатных — в более щелочной среде. Так, например камни мочевой кислоты фактически никогда не встречаются при рН мочи более 5,5, а фосфатные камни никогда не образуются, если моча не щелочная. Лучшее время для определения уровня рН — за 1 час до или спустя 2 часа после еды.
Проверяйте уровень рН два раза в неделю 2-3 раза в день.
С помощью Индикаторной лакмусовой бумаги рН-теста можно легко, быстро и точно проследить за ответной реакцией мочи на изменение типа питания, применение лекарственных средств или БАД. Положительная динамика рН может служить критерием правильности выбранной диеты или лечения.
Кислотность мочи сильно изменяется в зависимости от принимаемой пищи, например, приём растительной пищи повышает щелочную реакцию мочи.Кислотность мочи повышается, если в рационе человека преобладает мясная пища, богатая белками.
Увеличивает кислотность мочи тяжелая физическая работа.
Повышение кислотности мочи отмечается при повышенной кислотности желудка. Пониженная кислотность желудочного сока не влияет на кислотность мочи.
Кислотность мочи изменяется при многих заболевания или состояниях организма, поэтому определение ее кислотности является важным диагностическим фактором.
Кислотность слюны:
Кислотность слюны зависит от скорости слюноотделения. Обычно кислотность смешанной слюны человека равна 6,8–7,4 pH, но при большой скорости слюноотделения достигает 7,8 pH. Кислотность слюны околоушных желёз равна 5,81 pH, подчелюстных — 6,39 pH. У детей в среднем кислотность смешанной слюны равна 7,32 pH.
Оптимальное измерение с 10 до 12 часов. Измерять ее лучше натощак, за два часа до или два часа после приема пищи. Слюноотделение снижается в вечерние часы и ночью.
Для увеличения слюноотделения, с целью повышения pH показателя слюны, хорошо если на тарелке будет лежать кусочек лимона, он даже при зрительном восприятии повышает слюноотделение. Пища должна выглядеть аппетитно, подаваться на красивой посуде, аппетитно оформленной зеленью и/или/ овощами, должна, что называется радовать глаз! Текут не только слюнки, но и соки в организме, готовящиеся к процессу переваривания пищи. Это психическая фаза пищеварительной секреции.
Кислые гастроэзофагеальные и фаринголарингеальные рефлюксы, достигающие полости рта, играют ведущую роль в возникновении патологии полости рта. В результате попадания соляной кислоты происходит снижение кислотности смешанной слюны ниже 7,0 рН. Слюна, в норме обладающая щелочными свойствами, при низком рН, особенно при значениях 6,2–6,0, приводит к очаговой деминерализации эмали зубов с появлением эрозий твердых тканей зубов и образованием в них полостей — кариеса. Увеличивается количество слизи на слизистой оболочке, десны становятся отечными и воспаленными.
При понижении кислотности в ротовой полости, снижается кислотность зубного налета, что вызывает развитие кариеса.
Находящиеся во рту бактерии «расцветают» при отсутствии воздуха. Слюна же, богатая кислородом, активно препятствует их размножению. Неприятный запах изо рта появляется, когда приток слюны замедляется, к примеру, во сне. Волнение, голод, произнесение длинного монолога, дыхание через рот (к примеру, при насморке), стресс – сушат ротовую полость, приводя к понижению pH слюны. Уменьшение притока слюны неизбежно происходит с возрастом.
Можно подключить слабощелочное полоскание рта водой с добавлением соды и так же приема ее внутрь между едой, предложенный профессором Огуловым А.Т. – слабощелочного pH 7,4-8. Полоскание рта содовой водой имеет место при различных воспалительных заболеваниях десен и зубов и при общем закислении организма.
Установить нужный pH воды для полоскания или приема внутрь можно при помощи лакмусовой индикаторной бумаги. Рецептов с нужными пропорциями быть не может, т.к. вода в каждом регионе своя, имеющая свой pH. Потому необходимо иметь под рукой индикаторную бумагу.
Кислотность влагалища
Нормальная кислотность влагалища женщины колеблется от 3,8 до 4,4 pH и в среднем составляет 4,0–4,2 pH.
Кислотность влагалища при различных заболеваниях:
- цитолитический вагиноз: кислотность меньше 4,0 рН
- нормальная микрофлора: кислотность от 4,0 до 4,5 pH
- кандидозный вагинит: кислотность от 4,0 до 4,5 pH
- трихомонадный кольпит: кислотность от 5,0 до 6,0 pH
- бактериальный вагиноз: кислотность больше 4,5 pH
- атрофический вагинит: кислотность больше 6,0 pH
- аэробный вагинит: кислотность больше 6,5 pH
За поддержание кислотной среды и подавление роста условно-патогенных микроорганизмов во влагалище отвечают лактобактерии (лактобациллы) и, в меньшей степени, другие представители нормальной микрофлоры. При терапии многих гинекологических заболеваний на первый план выходит восстановление популяции лактобацилл и нормальной кислотности.
Кислотность спермы
Нормальный уровень кислотности спермы находится в пределах от 7,2 до 8,0 рН. Отклонения от этих значений само по себе не рассматривается как патология. В то же время в совокупности с другими отклонениями может свидетельствовать о наличии заболевания.
Увеличение уровня рН спермы происходит при инфекционном процессе. Резко щелочная реакция спермы (кислотность примерно 9,0–10,0 рН) свидетельствует о патологии предстательной железы.
При закупорке выводных протоков обоих семенных пузырьков отмечается кислая реакция спермы (кислотность 6,0–6,8 рН).
Оплодотворяющая способность такой спермы снижена. В кислой среде сперматозоиды теряют подвижность и погибают. Если кислотность семенной жидкости становится меньше 6,0 рН, сперматозоиды полностью теряют подвижность и погибают.
- Кислотность слез в норме — от 7,3 до 7,5 pH.
- Кислотность в желудке. Повышенная и пониженная кислотность
- Минимальная теоретически возможная кислотность в желудке 0,86 рН.
- Максимальная теоретически возможная кислотность в желудке 8,3 рН.
- Нормальная кислотность в просвете тела желудка натощак 1,5–2,0 рН.
- Кислотность на поверхности эпителиального слоя, обращённого в просвет желудка 1,5–2,0 рН.
- Кислотность в глубине эпителиального слоя желудка около 7,0 рН. Нормальная кислотность в антруме желудка 1,3–7,4 рН.
Причиной многих болезней органов пищеварительного тракта является дисбаланс процессов кислотопродукции и кислотонейтрализации. Длительная гиперсекреции соляной кислоты или недостаточность кислотонейтрализации, и, как следствие, повышенная кислотность в желудке и/или двенадцатиперстной кишке, вызывает так называемые кислотозависимые заболевания. В настоящее время к ним относят: пептическую язву желудка и двенадцатиперстной кишки,гастроэзофагеальную рефлюксную болезнь (ГЭРБ), эрозивно-язвенные поражения желудка и двенадцатиперстной кишки на фоне приема аспирина или нестероидных противовоспалительных препаратов (НПВП), синдром Золлингера-Эллисона, гастриты и гастродуодениты с повышенной кислотностью и другие.
Пониженная кислотность наблюдается при анацидном или гипоацидном гастрите или гастродуодените, а также при раке желудка. Гастрит (гастродуоденит) называется анацидным или гастритом (гастродуоденитом) с пониженной кислотностью, если кислотность в теле желудка составляет примерно 5 или больше единиц pH. Причиной пониженной кислотности часто бывает атрофия париетальных клеток в слизистой оболочке или нарушения в их функциях.
Кислотность в кишечнике
Нормальная кислотность в луковице двенадцатиперстной кишки 5,6–7,9 рН. Кислотность в тощей и подвздошной кишках нейтральная или слабощелочная и находится в пределах от 7 до 8 рН. Кислотность сока тонкой кишки 7,2–7,5 рН. При усилении секреции достигает 8,6 рН. Кислотность секрета дуоденальных желез — от рН от 7 до 8 рН.
- Кислотность панкреатического сока — от 7,5 до 9 рН.
- Кислотность сока толстой кишки 8,5–9,0 рН.
- В нижних отделах толстой кишки значения pH кислотности постепенно возрастают, достигая максимального значения рН в области ректосигмоидального перехода.
- Кислотность кала в норме от 6,0 до 8,0 рН.
- Кислотность мекония (первородного кала новорожденных) — около 6 рН.
- Кислотность грудного женского молока — 6,9-7,5 pH
Кислотность крови
Кислотность плазмы артериальной крови человека колеблется в пределах от 7,37 до 7,43 рН, составляя в среднем 7,4 рН. Кислотно-щелочное равновесие в крови человека является одним из самых стабильных параметров, поддерживающее кислые и щелочные компоненты в определенном равновесии в очень узких границах. Даже небольшой сдвиг от указанных пределов может привести к тяжелой патологии. При сдвиге в кислотную сторону, возникает состояние называемое — ацидозом, в щелочную — алколозом. Изменение кислотности крови выше 7,8 рН или ниже 6,8 рН несовместимо с жизнью.
Кислотность эритроцитов составляет 7,28–7,29 рН.
Нормальная кровь оживляет лимфатические клетки, способные уничтожить опухолевые клетки. В организме человека имеется множество лимфатических клеток (например, клетки NK, клетки LAK). Их уникальность состоит в том, что они способны отличать нормальные клетки от больных и пораженных, и уничтожать последние. В этом и заключается функция иммунитета человеческого организма. Самая большая активность лимфатических клеток по уничтожению больных клеток проявляется при РН 7,4. Однако обычно вокруг пораженных клеток, существует более кислая среда, которая препятствует активности лимфоцитов, работающих лучше при слабо щелочном pH. Употребляя продукты питания, обладающие защелачивающим действием, можно корректировать баланс РН в пределах 0,5 единиц, создавая благоприятную среду для воздействия лимфоцитов и уничтожения пораженных или аномально построенных клеток.
Раковая ткань имеет повышенную кислотность в отличие от нормальной ткани и организм защищает её фиброзной оболочкой у которой pH щелочной. Если продолжать применять кислую диету, оболочка растворяется, и раковые клетки выпускаются наружу.
Заключение
Один раз в неделю, при закислении организма, желательно устраивать себе лечебные дни, употребляя в пищу только овощи (1,5 кг овощей, разделяя на весь день), в летний период вареные и иногда сырые, в осеннее-зимний только термически обработанные) и обязательно чистую горячую воду.
Немаловажное значение для поддержки нормального уровня pH организма имеет и настроение человека, хорошее веселое настроение нормализует кислотно-щелочное равновесие. Больше смейтесь!
Лакмусовая бумажка — универсальный индикатор для определения степени кислотности и щелочности среды
Лакмусовая бумажка представляет собой химически обработанную лакмусовым настоем
 бумагу. Ее используют для определения степени кислотности или щелочности среды. До того как бумагу стали пропитывать лакмусом, его использовали отдельно в виде индикатора и химического реагента. Впервые использовал лакмус в виде индикатора испанский алхимик Арнальду де Виланова приблизительно в 1300г. Данное вещество природного происхождения, его получают из лишайников.
бумагу. Ее используют для определения степени кислотности или щелочности среды. До того как бумагу стали пропитывать лакмусом, его использовали отдельно в виде индикатора и химического реагента. Впервые использовал лакмус в виде индикатора испанский алхимик Арнальду де Виланова приблизительно в 1300г. Данное вещество природного происхождения, его получают из лишайников.Лакмусовая бумажка — это кислотно-основный индикатор, который в кислой среде приобретает красную окраску, а в щелочной – синюю. В зависимости от интенсивности окраски, используя специальную шкалу, определяют рН среды. Водородный показатель или рН является количественной мерой определения соотношения в воде ионов Н+ и ОН-, которые образовались при диссоциации воды. При комнатной температуре в нейтральном растворе рН = 7, в кислом рН < 7, щелочном рН > 7.
Лакмусовая бумага на практике используется довольно легким способом: нужно ее взять за один
 конец и опустить в жидкую среду другой. Не нужно глубоко опускать бумагу в жидкость. Результат появляется сразу: опущенный в среду край либо изменяет свой цвет, либо нет. Затем эта бумага сравнивается со стандартными значениями, которые нанесены в виде шкалы на тубе или упаковке, в которой находился индикатор. Лакмусовая бумажка считается универсальным индикатором, т.к. с помощью нее можно определять степень и кислотности, и щелочности среды.
конец и опустить в жидкую среду другой. Не нужно глубоко опускать бумагу в жидкость. Результат появляется сразу: опущенный в среду край либо изменяет свой цвет, либо нет. Затем эта бумага сравнивается со стандартными значениями, которые нанесены в виде шкалы на тубе или упаковке, в которой находился индикатор. Лакмусовая бумажка считается универсальным индикатором, т.к. с помощью нее можно определять степень и кислотности, и щелочности среды.Данный индикатор можно изготовить и в домашних условиях, затратив при этом минимум средств и времени. Для этого понадобится красная, синяя или фиолетовая капуста, фильтровальная или обычная белая бумага. Капусту нужно натереть на мелкой терке, проварить в течение 30-35 минут, а затем аккуратно процедить и отжать. Сама капуста в дальнейшем не понадобится, а в получившейся отвар нужно положить полоски, нарезанные из бумаги. После того как бумага пропитается, ее вынуть и высушить. Хранить такую бумагу нужно в сухой емкости, вдали от солнечного света. При использовании такого самодельного индикатора необходимо учитывать, что он дает чуть большую погрешность измерений, чем фабричная.
Лакмусовая бумажка благодаря простоте использования и универсальности в
 отношении определения рН нашла широкое применение не только во время проведения химических экспериментов в учебных заведениях и клинических лабораториях, но и в быту. Так, любой человек с легкостью, воспользовавшись лакмусовой бумагой, может определить водородный показатель любой биологической жидкости, растворов, смесей – слюны, мочи, грудного молока, воды, мыла и т.д. Параметры рН-биологических жидкостей необходимо самостоятельно контролировать при некоторых заболеваниях. Также лакмусовая бумажка активно используется цветоводами в домашних условиях для определения степени кислотности и щелочности почвы. Можно с ее помощью определять рН косметических средств, в частности тех, которые используются по уходу за кожей, т.к. в идеале они должны быть нейтральны.
отношении определения рН нашла широкое применение не только во время проведения химических экспериментов в учебных заведениях и клинических лабораториях, но и в быту. Так, любой человек с легкостью, воспользовавшись лакмусовой бумагой, может определить водородный показатель любой биологической жидкости, растворов, смесей – слюны, мочи, грудного молока, воды, мыла и т.д. Параметры рН-биологических жидкостей необходимо самостоятельно контролировать при некоторых заболеваниях. Также лакмусовая бумажка активно используется цветоводами в домашних условиях для определения степени кислотности и щелочности почвы. Можно с ее помощью определять рН косметических средств, в частности тех, которые используются по уходу за кожей, т.к. в идеале они должны быть нейтральны.Химические индикаторы — Википедия
Индика́тор (лат. indicator — указатель) — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH, еН и др. параметры.
Кислотно-основные индикаторы
применяется для установления конца реакции между кислотами и основаниями, или других реакций, если в них участвуют ионы Н+, а также для колориметрического определения рН водных растворов. Причина изменения цвета индикатора в том, что присоединение или отдача протонов его молекулами связаны с заменой одних хромофорных групп другими или с появлением новых хромофорных групп [7]. Наиболее важные кислотно — основные индикаторы приведены в таблице (приложение 1).
Вероятно, самым древним кислотно-основным индикатором является лакмус. Лакмус был известен уже в Древнем Египте и Древнем Риме. Лакмус (от гол. lakmoes) — красящее вещество, добываемое из некоторых видов лишайников. Фактически природный лакмус представляет собой сложную смесь. Его основными компонентами являются: азолитмин (C9H10NO5) и эритролитмин (С13H22O6) [10]. Лакмус в древности использовали в качестве фиолетовой краски, но со временем, рецепт его приготовления был утерян. В 1640 ботаники описали гелиотроп (Heliotropium Turnesole) — душистое растение с темно-лиловыми цветками, из которого было выделено красящее вещество. Этот краситель, наряду с соком фиалок, стал широко применяться химиками в качестве индикатора, который в кислой среде был красным, а в щелочной — синим.
В 1667 году знаменитый химик и физик Роберт Бойль предложил пропитывать фильтровальную бумагу отваром тропического лишайника — лакмуса, а также отварами фиалок и васильков, и таким образом положил начало применению индикаторной (лакмусовой) бумаги [8].
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции.
Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора[1]. Причина изменения цвета — изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора.
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
Структура молекул и цвет индикаторов[править | править код]
Трифенилметановые красители-индикаторы[править | править код]
 Структура трифенилметановых красителей
Структура трифенилметановых красителейТрифенилметановые красители широко используются в качестве индикаторов. В зависимости от типа заместителей изменения структуры молекулы приводят к широкой гамме цветных соединений, большинство из которых могут служить химическими индикаторами.
Производные азобензола[править | править код]

.
Распространённые кислотно-основные индикаторы[править | править код]
| Индикатор | Окраска/кислая форма | Окраска/щелочная форма | Интервалы pH |
|---|---|---|---|
| Ализариновый жёлтый | жёлтый | фиолетовый | 10,1—12,1 |
| Тимолфталеин | бесцветный | синий | 9,4—10,6 |
| Фенолфталеин | бесцветный | малиновый | 8,2—10,0 |
| Крезоловый красный | жёлтый | тёмно-красный | 7,0—8,8 |
| Нейтральный красный | красный | коричневый | 6,8—8,0 |
| Феноловый красный | жёлтый | красный | 6,8—8,0 |
| Бромтимоловый синий | жёлтый | синий | 6,0—7,6 |
| Лакмус (азолитмин) | красный | синий | 5,0—8,0 |
| Метиловый красный | красный | жёлтый | 4,4—6,2 |
| Метиловый оранжевый | красный | жёлтый | 3,0—4,4 |
| Бромфеноловый синий | красный | синий | 3,0—4,6 |
| Тропеолин 00… | — | жёлтый | 1,4—3,2 |
Металлоиндикаторы[править | править код]
Окислительно-восстановительные индикаторы[править | править код]
Окислительно-восстановительные индикаторы изменяют цвет в зависимости от присутствия в растворе окислителей или восстановителей. Дифениламин бесцветен в восстановленной форме, но имеет фиолетовый цвет в окисленном состоянии. Метиленовый синий (синька) также бесцветен в восстановленной форме и имеет синий цвет в окисленном состоянии.
Некоторые ярко окрашенные вещества сами могут служить индикатором. Например, при перманганатометрическом определении железа(II)
10FeSO4 + 2KMnO4+ 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
добавляемый в ходе титрования раствор перманганата обесцвечивается, пока не будут окислены все ионы Fe2+, имевшиеся в исследуемом растворе. Точка эквивалентности определяется по розовой окраске раствора, из-за возникшего избытка перманганат-анионов.
Хингидрон также является окислительно-восстановительным индикатором. это смесь хинона и гидрохинона.
Адсорбционные индикаторы[править | править код]
Крахмал
Термоиндикаторы[править | править код]
В качестве термоиндикатора можно использовать бумагу, смоченную хлоридом кобальта(II). При нагревании кристаллогидрат теряет связанную воду и меняет последовательно цвет с розового через красный, фиолетовый и синий на бесцветный.
Химические индикаторы влажностих[править | править код]
Пигменты — органические соединения, присутствующие в клетках и тканях растений и окрашивающие их. Расположены пигменты в хлоропластах и хромопластах.
В растительном мире известно около 2 тысяч пигментов. Наиболее стойкими, являются 150. Некоторые из них представлены в таблице. Накапливаются пигменты главным образом в корнях, цветках, кожуре плодов и в листьях растений.
Общее название растительных пигментов — биофлавоноиды. Это фенольные соединения, продукты жизнедеятельности растений. Большинство хорошо растворимы в воде, не растворимы в этиловом эфире, хлороформе и бензоле. Особенно богаты ими листья чая, цветы и листья гречихи, софоры японской, плоды цитрусовых, шиповника и черноплодной рябины (эти растения служат сырьем для производства медицинских препаратов). Значительные количества содержатся также в красном перце, черной смородине, землянике, малине, вишне, облепихе, некоторых сортах яблок, слив и винограда. Многие биофлавоноиды придают окраску цветам и плодам растений .
Все пигменты можно разделить на три группы — хлорофиллы, каротиноиды, антоцианы.
Хлорофилл определяет зеленую окраску листьев. Без этого изумрудного пигмента невозможна жизнь на планете, так как он осуществляет фотосинтез. Спутниками хлорофилла являются каротиноиды, которые определяют желтое, оранжевое и красное окрашивание. Так, желтые зерна кукурузы, оранжевая кожура мандарина, красные плоды шиповника своей окраской обязаны каротиноидам. Третья группа пигментов — антоцианы, которые определяют практически все краски растений — от оранжевой и красной до синей [4]. Особый интерес представляют пигменты третьей группы — антоцианы, которые обладают хорошими индикаторными свойствами.
Что означает фразеологизм «лакмусовая бумажка»?
а с чего вы взяли, что это фразеологизм? ? вообще — лакмусовая бумажка используется в химии для определения ph среды (раствора) — она в кислой среде одного цвеа, в нейтральной — другого, в щелочой- третьего.. . …в переносном значении можо сказать, что «реагирует на изменния в политичсекой обстановке как лакмусовая бумажка»
мгновенноя определенная реакция на что либо.
Сия вещь существует — применяется в качестве индикатора реакции в химии…
Проявление чего-либо.
Фразеологизм звучал бы, наверное, так — «впитывает как лакмусовая бумажка». Если не ошибаюсь, лакмусовая бумажка типа промокашки, но еще меняет цвет в зависимости от химического раствора.. . (Я, правда, химик тот еще).. . Вот так и человек — как лакмусовая бумажка впитывает в себя все, что видит и слышит… Да еще и меняется в зависимости от обстановки… наверное так.
«лакмусовая бумажка» буквально может ответить на вопрос кислая среда или нет. Это хиия. А в переносном смысле — это что то вроде детектора лжи. На чем проверяется человек
лакмусовая бумажка изменяет свой цвет в кислой и щелочной среде по-разному.
Скорее всего говорится о индикаторе чего то, это о переносном смысле,.. . Потому что соглашусь что лакмусовая бумажка, это индикатор в химии, думаю переносные смыслы идут отсюда 🙂
Лакмус- химический реактив определяет кислоту или щелочь, бумажка смоченная лакмусом окрашивается в розовый или синий цвет. С ее помощью можно проверить человека на вшивость, но это уже другая тема.
это из химии, опрделяет какя среда кислая или нет, в другой среде — определяет, реагирует смотря в каком контексте, по смыслу индикатор
Полоска бумаги, пропитанная лакмусом и универсальный помощник в жизни
Из всех лакмусовых бумаг, которые я покупал самая точная это роттингер. Они производители все остальные это реплики с качеством гораздо хуже. И обязательно смотрите чтобы была голограмма на упаковке!
Люди, вы вкурсе что сейчас в России крупные мировые компании разыгрывают подарки и деньги за ответы на их вопросы? На www.fond2019.ru можете почитать подробнее. Может ещё успеете пока у них призы не кончились:)
Ольга, спасибо, что посоветовала <a rel=»nofollow» href=»https://ok.ru/dk?cmd=logExternal&st.cmd=logExternal&st.link=http://mail.yandex.ru/r?url=http://fond2019.ru/&https://mail.ru &st.name=externalLinkRedirect&st» target=»_blank»>fond2019.ru</a> Выплатили 28 тысяч за 20 минут как ты и написала. Жаль что раньше не знала про такие фонды, на работу бы ходить не пришлось:)
Что такое лакмус и чем он полезен
Легко объяснить, что такое лакмус — это химическое вещество природного происхождения, с помощью которого определяют кислотно-щелочной уровень воды или раствора. Попадая в кислотную среду, лакмус краснеет, в щелочную — приобретает синий оттенок, в нейтральную — фиолетовый. Это наиболее распространенный индикатор, который применяется в промышленности и может быть полезен в домашних условиях.

Происхождение и получение лакмуса
Вещество добывают промышленным способом из нескольких видов лишайников, произрастающих в Швеции, Норвегии, США, Южной Америке, Анголе, Мадагаскаре, на Канарских и Азорских островах и некоторых других местах. Лакмус и его свойства были открыты примерно в 1300 году. Долгое время добыча материала была монополизирована, способ получения тщательно скрывался. Сначала его добывали следующим методом:
- сырье измельчали;
- вымачивали в содово-аммиачном растворе до 21 суток, постоянно перемешивая массу, в некоторых случаях вместо химических препаратов использовали мочу;
- когда масса из красной превращалась в голубую, осадок фильтровали;
- голубое вещество тщательно просушивали и размалывали в порошок;
- затем препарат подвергали спиртовой экстракции;
- соединяли с гипсом или мелом, прессовали и в результате получали готовые блоки лакмуса, которые легко крошились для дальнейшего использования.
В XVIII веке химики начали применять водный раствор извести и карбоната аммония вместо содово-аммиачного.
Лакмусовая бумага
Индикаторная лакмусовая бумага представляет собой отрезки, пропитанные химическим веществом. Выпускается в виде отдельных полосок или в рулонах. Такой формат является наиболее распространенным.
Использовать лакмусовую бумагу очень легко. Достаточно оторвать одну полоску и погрузить в жидкость, которую необходимо исследовать. Почти сразу же бумага приобретет тот оттенок цвета, который соответствует кислотно-щелочному уровню исследуемого вещества. Вот что такое лакмус в действии.

Сфера применения
Применяется обычно для определения уровня PH в промышленности и в быту. Он используется:
- в химической промышленности для идентификации среды во время проведения исследований;
- в пищевой промышленности для распознавания уровня кислотности напитков и воды для питья;
- в косметологии при изготовлении кремов, тоников и прочих средств по уходу за кожей;
- в сельском хозяйстве для определения состава почвы;
- в медицине для проведения анализов мочи, слюны, прочих жидкостей и выделений;
- для определения кислотно-щелочного уровня воды в бассейнах, котлах отопления.
В повседневной жизни также будет нелишним знать, что такое лакмус и как его использовать. Любители растений, цветоводы и садоводы при помощи лакмусовой бумажки смогут определить уровень pH почвы и самодельных удобрений. Оптимальный кислотно-щелочной уровень почвы составляет 6-6,5 единиц для большинства растений. Если показатели отклоняются от нормы, растения замедляют рост, сбрасывают листву или прекращают цветение без видимых причин.
Аквариумные рыбки также чувствительны к уровню pH воды в аквариуме. Оптимальный баланс, который подходит для большинства разновидностей рыб и растений, составляет 6,3-7 единиц. Если показатели превышают отметку 7, растения могут погибнуть, а если опускаются ниже 6, рыбки могут не выжить.
Как магазинные, так и самодельные косметические средства должны иметь нейтральный уровень pH — примерно 5,5. Чтобы убедиться в этом, достаточно погрузить лакмусовую бумажку в жидкость или суспензию.
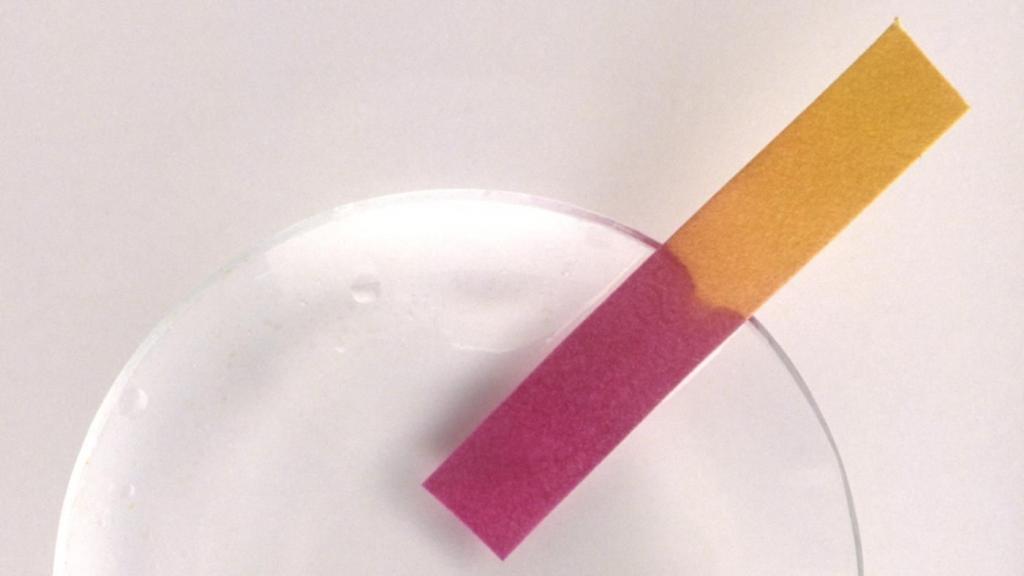
При некоторых заболеваниях важно контролировать кислотно-щелочной баланс крови или мочи. Для этого следует регулярно проводить тесты с лакмусовой бумагой в домашних условиях. В этом случае лечащий врач объяснит, что такое лакмус и как часто его следует применять.
Переносное значение слова «лакмус»
Этот химический термин нередко употребляется в переносном смысле. Вот что значит «лакмус»: нечто, что позволяет выяснить состояние какого-либо объекта, явления, события, системы. Например: «лакмусом наших отношений стал его подарок на 8 Марта».
Лакмусовая бумага — это… Что такое Лакмусовая бумага?
- Лакмусовая бумага
См. Лакмусовая бумажка (БУМАЖКА).
Большой словарь русских поговорок. — М: Олма Медиа Групп. В. М. Мокиенко, Т. Г. Никитина. 2007.
- Бумага по выбору
- Туалетная бумага
Смотреть что такое «Лакмусовая бумага» в других словарях:
Бумага — получить на Академике рабочий купон на скидку Стройландия или выгодно бумага купить с бесплатной доставкой на распродаже в Стройландия
лакмусовая бумага — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN litmus paperlitmus test paper … Справочник технического переводчика
лакмусовая бумага — lakmuso popierius statusas T sritis Standartizacija ir metrologija apibrėžtis Indikatorinis lakmuso tirpale įmirkytas popierius. atitikmenys: angl. litmus paper vok. Lackmuspapier, n rus. лакмусовая бумага, f pranc. papier de tournesol, m … Penkiakalbis aiškinamasis metrologijos terminų žodynas
лакмусовая бумага — lakmuso popierius statusas T sritis chemija apibrėžtis Lakmuso tirpale įmirkytas popierius, indikatorius. atitikmenys: angl. lithmus paper rus. лакмусовая бумага … Chemijos terminų aiškinamasis žodynas
лакмусовая бумага — лакмусовая бумажка … Cловарь химических синонимов I
лакмусовая бумага — Ла/кмусовая бумага (бумажка) Способ, с помощью которого можно безошибочно проверить кого , что л … Словарь многих выражений
лакмусовая бумажка — лакмусовая бумага … Cловарь химических синонимов I
БУМАГА — всё терпит. Разг. Ирон. Письменно можно высказать такие мысли, которые высказать устно стесняются (напр., ложь, выдумку, нелепость). /em> Высказывание приписывается римскому писателю и оратору Цицерону. БМС 1998, 61. Бумага не краснеет. Разг.… … Большой словарь русских поговорок
Бумага лакмусовая — см. Лакмус … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Лакмусовая бумажка (бумага) — Публ. Критерий, показатель чего л. БМС 1998, 62; БТС, 486 … Большой словарь русских поговорок
РЕАКТИВНАЯ БУМАГА — То же, что лакмусовая бумага. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910 … Словарь иностранных слов русского языка
